SO2 là một loại khí được sử dụng rộng rãi trong sản xuất và đời sống. Để biết tính chất, ứng dụng, quy trình, sơ đồ phản ứng cũng như điều chế SO2 quý bạn đọc đừng bỏ qua những thông tin dưới đây của ruaxetudong.org, chắc chắn sẽ giúp ích với bạn đó!
Nội dung bài viết
SO2 là gì? Tính chất hóa học và vật lý của sulfur dioxit
SO2 là chất gì?
Trước khi tìm hiểu về cách điều chế SO2 thì bạn cần phải biết SO2 là gì. SO2 là một hợp chất hóa học có tên gọi là lưu huỳnh đioxit hay anhidrit sunfurơ. Là chất khí vô cơ không màu, nặng hơn không khí, là sản phẩm chính của sự đốt cháy hợp chất lưu huỳnh.
Tính chất vật lý của SO2
- Là chất khí không màu và nặng hơn không khí
- Tan trong nước
- Khối lượng riêng: 2,551g/l, gas
- Điểm nóng chảy: -72,4℃ (200.75 K)
- Điểm sôi: -10℃ (263 K)
- Độ hòa tan trong nước: 9,4 g/100ml (ở 25℃)
Tính chất hóa học của khí SO2
- SO2 dễ bị oxy hóa thành SO3 trong khí quyển dưới chất xúc tác do quá trình quang hóa.
- Khí SO2 là một axit yếu, tác dụng với nước tạo ra H2SO3: SO2 + H2O → H2SO3
- Tác dụng với dung dịch kiềm tạo ra muối sunfit hoặc hidrosunfit hoặc cả hai loại:
SO2 + NaOH → NaHSO3
SO2 + 2NaOH → Na2SO3 + H2O
- Khí SO2 vừa là chất oxy hóa, vừa là chất khử
- Chất khử phản ứng với chất oxy hóa mạnh
2SO2 + O2 → 2SO3 (V2O5, 450℃)
Cl2 + SO2 + 2H2O → H2SO4 + 2HCl
- Làm mất màu nước brom: SO2 + Br2 + 2H2O → 2HBr + H2SO4
- Làm mất màu dung dịch thuốc tím: 5SO2 + 2KMnO4 + 2H2O → K2SO4 + 2MnSO4 + 2H2SO4
- Sulfur dioxit là chất oxy hóa mạnh, tác dụng với chất khử mạnh
SO2 + 2H2S → 3S + 2H2O
SO2 + 2Mg → S + 2MgO
Ứng dụng của khí SO2 trong đời sống và sản xuất công nghiệp
Ngành sản xuất rượu
Lưu huỳnh đioxit trong sản xuất rượu được sử dụng với tỷ lệ rất nhỏ, nồng độ SO2 dưới 50ppm nên rượu vẫn giữ được hương vị thơm ngon. Khí SO2 còn được sử dụng để làm sạch các thiết bị trong nhà máy sản xuất rượu.

Làm chất tẩy trắng bột giấy, dung dịch đường
Trong quá trình tiếp xúc với lignin và một số hợp chất khác trong bột giấy hoặc giấy, SO2 sẽ làm mất màu một số hợp chất, tạo ra hợp chất hữu cơ màu trắng sáng.
Khi sản xuất đường tinh luyện từ mía, một ít nước vôi trong và sục khí SO2 sẽ được cho vào nước mía. Lưu huỳnh đioxit sẽ làm trong nước mía bằng cách kết tủa nước vôi trong, khi cô đặc sẽ thu được đường tinh luyện màu trắng.
Làm chất bảo quản cho các loại thực phẩm khô
Khí SO2 được sử dụng làm chất bảo quản các loại hoa quả sấy khô như vải, mơ, nho,…nhờ khả năng ngăn cản sự phát triển của một số loại vi khuẩn và nấm gây hại cho thực phẩm. Nhờ đó giúp thực phẩm không bị hư hỏng, thối rữa, giữ màu sắc tươi ngon trong thời gian dài.
Bên cạnh đó, khí SO2 được sử dụng làm thuốc thử để nhận biết các chất và được sử dụng như một dung môi trơ trong phòng thí nghiệm.
Cách điều chế SO2
Khí SO2 được ứng dụng trong nhiều lĩnh vực khác nhau nên có không ít người đang tìm hiểu về điều chế SO2 trong công nghiệp và phòng thí nghiệm. Hãy theo dõi “ngay và luôn” thông tin dưới đây của ruaxetudong.org để biết điều chế SO2 chính xác nhất nhé!
Cách điều chế SO2 trong phòng thí nghiệm
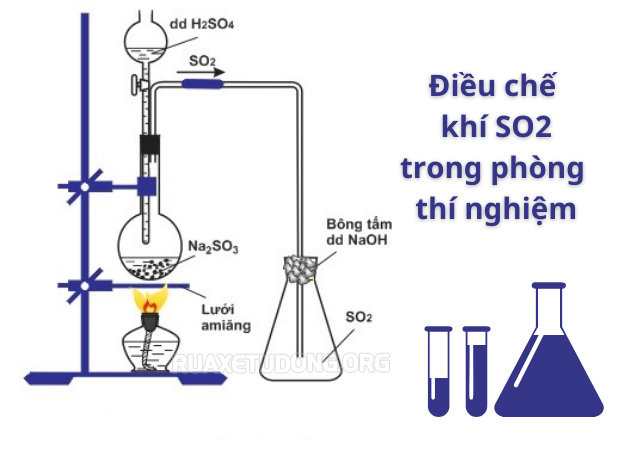
Trong phòng thí nghiệm, SO2 được điều chế bằng cách đẩy không khí, cho muối sunfit tác dụng với axit mạnh như HCl, H2SO4. Pt điều chế SO2 trong phòng thí nghiệm như sau:
PTHH: Na2SO3 + 2HCl → 2NaCl + H2O + SO2
Trong đó: Na2SO3 là: Natri Sunfit; HCl: Axit Clohidric, NaCl: Natri Clorua
Hoặc phương pháp thu được SO2 trong phòng thí nghiệm theo phương trình sau:
PTHH: Na2SO3 + H2SO4 → Na2SO4 + H2O + SO2
Trong đó: H2SO4 là: Axit Sunfuric và Na2SO4 là Natri Sunfat
Khí SO2 còn được điều chế bằng cách cho Cu tác dụng với H2SO4 đặc.
PTHH như sau: Cu + 2H2SO4đặc → CuSO4 + SO2 + 2H2O
Trong đó: CuSO4 là: Đồng (II) Sunfat
Cách điều chế SO2 trong công nghiệp
Trong công nghiệp điều chế SO2 bằng 4 cách sau:
- Đốt cháy lưu huỳnh: S + O2(to) → SO2
- Đốt cháy Hidro Sunfua H2S trong môi trường có oxi dư: 2H2S + 3O2 → 2H2O + 2SO2
- Cho kim loại phản ứng với axit H2SO4 đặc nóng: Cu + 2H2SO4 → CuSO4 + SO2 + 2H2O
- Đốt cháy mẫu quặng pirit sắt: 4FeS2 + 11O2 → 2Fe2O3 + 8SO2
N trong hóa học là gì? Tìm hiểu các kí hiệu công thức hóa học
Dãy hoạt động hóa học của kim loại là gì? Mẹo học thuộc dễ nhớ nhất
Cách phân biệt khí SO2 với CO2
Ngoài việc tìm hiểu về điều chế khí SO2 trong công nghiệp, phòng thí nghiệm thì bạn cũng cần phải biết cách phân biệt SO2 với CO2. Có 2 cách phân biệt được mọi người áp dụng đó là:
Dùng thuốc tím [KMnO4] hoặc Br2
![Dùng thuốc tím [KMnO4] để phân biệt SO2 và CO2](https://ruaxetudong.org/wp-content/uploads/2023/02/dung-thuoc-tim-de-phan-biet-so2-va-co2.jpg)
Do chỉ số oxy hóa của lưu huỳnh trong SO2 đang ở +4 nên nó có thể nhường 2 electron xuất hiện trong quá trình oxy hóa. Trong khí đó, khí CO2 với số oxy của cacbon C đang ở mức cao nhất là +4. Vì vậy, CO2 không thể làm mất màu thuốc tím được. Phương trình SO2 phản ứng với KMnO4 thuốc tím là:
5SO2 + 2KMnO4 + 2H2O → 2H2SO4 + K2SO4 + 2MnSO4
Khí SO2 làm mất màu dung dịch Br2, phương trình như sau: SO2 + Br2 + 2H2O → H2SO4 + 2HBr
Sử dụng cánh hoa hồng để phân biệt khí SO2 và CO2
Như thông tin ở trên, khí SO2 được biết đến là một chất khử mạnh khi số oxy hóa của lưu huỳnh (S) đang ở mức +4 có thể lên đến mức cao nhất là +6. Cánh hoa hồng chứa red rose pigment chính là yếu tố quan trọng để thay đổi số oxy hóa trong lưu huỳnh. Chất này tạo nên màu đỏ cho cánh hoa hồng.
Khi gặp SO2 sẽ bị oxy hóa, biến thành dạng reduced pigment có màu trắng. Quan sát hiện tượng nếu thấy cánh hoa hồng bị mất màu sẽ là SO2 còn không làm mất màu là khí CO2.
Với các thông tin có trong bài viết trên đây, hy vọng sẽ giúp bạn biết cách điều chế SO2. Truy cập ruaxetudong.org để cập nhật thêm nhiều thông tin hữu ích khác về hóa học, toán học,…




